La sete di elettroni |
 |
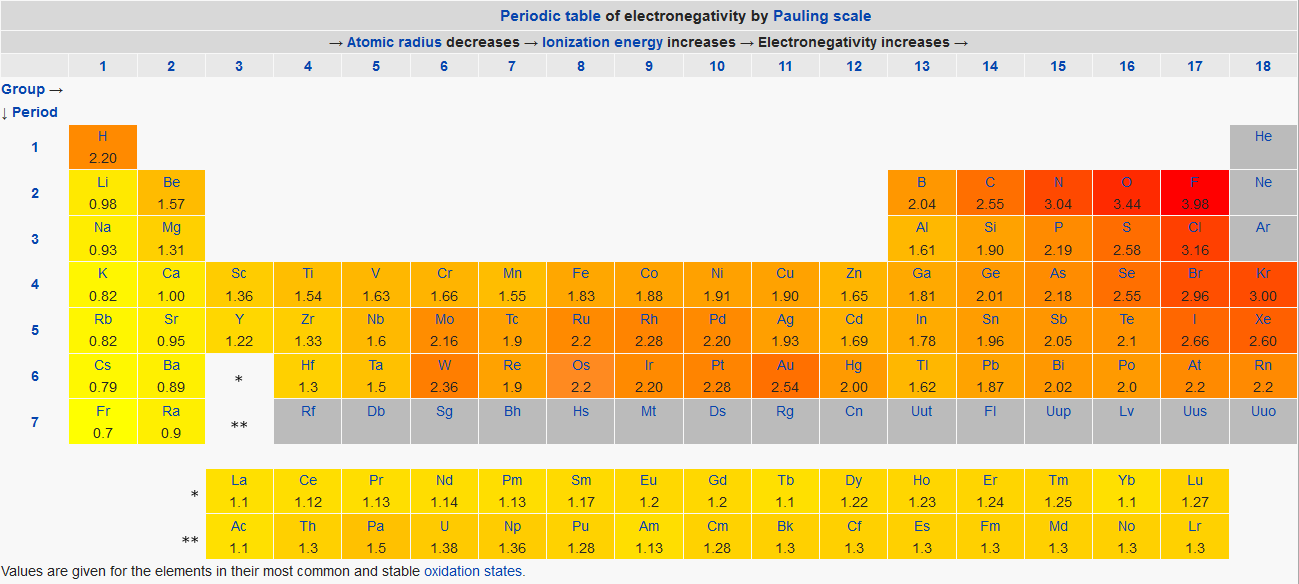
La sete di elettroniApprofondimento sull'elettronegativitàL'elettronegatività è la misura della tendenza di un atomo ad attirare a sé gli elettroni all'interno di una molecola. Gli atomi più elettronegativi sono quelli che nella tavola periodica si trovano in alto a destra, perché l'elettronegatività aumenta lungo il periodo e diminuisce lungo il gruppo. L'elemento più elettronegativo è il fluoro. Esistono varie scale per la misura dell'elettronegatività: la prima, proposta nel 1932 dal Premio Nobel per la Chimica Linus Pauling, prevede che la differenza di elettronegatività fra due eteroatomi A e B in una molecola sia data dalla formula: | xA - xB | = 0,102 * ΔE1/2dove ΔE rappresenta la differenza in energia fra il legame A-B reale e il legame A-B puramente covalente che è impossibile da misurare perché non esiste, a meno che l'effettivo legame A-B non sia perfettamente covalente, come nei casi in cui si hanno due atomi uguali. Se gli atomi fossero uguali, avremmo che la differenza fra il legame reale e quello fittizio è nulla, pertanto la differenza in elettronegatività sarebbe nulla. Ma poiché è impossibile misurare sperimentalmente il valore di un legame covalente fittizio che sia al 100% apolare fra due atomi diversi A e B, Pauling decise di utilizzare la media aritmetica fra le due energie di legame A-A e B-B, come se il covalente puro A-B fosse un'esatta media dei due casi limite in cui ogni atomo è legato con se stesso. Quindi: ΔE = EA-B - 0,5 (EA-A + EB-B)Per calcolare il valore di un'elettronegatività, è necessario però conoscere ancora un valore, quello di xB, e per fare questo è opportuno fissare convenzionalmente l'elettronegatività di un elemento ad un preciso numero. La scelta di Pauling fu quella di attribuire all'idrogeno il valore 2,2. Per trovare un xA, basta sostituire il valore di 2,2 in xB e condurre le dovute misurazioni in una qualsiasi molecola biatomica contenente l'elemento A e l'idrogeno. Caratteristica fondamentale della scala di Pauling è che si basa dunque su dati termochimici, ossia sulle energie di legame delle molecole. Si noti che i gas nobili non hanno valori noti di elettronegatività in questa scala perché al tempo di Pauling si ritenevano inerti al punto da non formare molecole, e quindi non rientravano nella definizione. Nel 1934, lo scienziato statunitense Robert Mulliken propose un'altra scala per la misura dell'elettronegatività, che la definisce come la media aritmetica fra l'energia di ionizzazione (o potenziale di ionizzazione) e l'affinità elettronica: xM = 0,5 (EA + IP)Se, però, osserviamo un diagramma energetico degli orbitali molecolari, possiamo notare qualcosa di interessante:
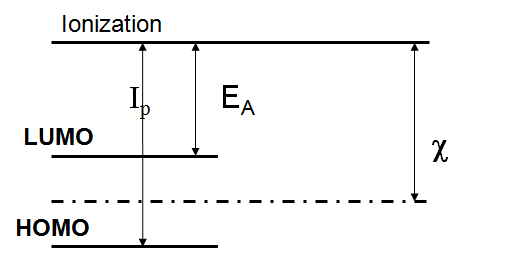
In questo diagramma, l'energia assume valori maggiori andando verso l'alto. Il livello dell'HOMO (highest occupied molecular orbital) è quello dell'orbitale molecolare occupato a più alta energia, mentre quello del LUMO (lowest unoccupied molecular orbital) è l'orbitale molecolare non occupato a più bassa energia. La ionizzazione avviene quando il contributo energetico è talmente grande da fare in modo che l'elettrone non sia più vincolato al nucleo dell'atomo, e viene considerato a distanza infinita dall'atomo. Notiamo che le seguenti corrispondenze: - la distanza HOMO - ionizzazione è pari all'energia di ionizzazione perché corrisponde all'energia necessaria ad allontanare un elettrone dal livello più esterno; Ne deriva che la stessa definizione di elettronegatività di Mulliken può essere riformulata nel modo seguente: l'elettronegatività è la media aritmetica delle energie di HOMO e LUMO - o, con la matematica: xM = 0,5 (EHOMO + ELUMO)Caratteristica importante di questa scala è quella di avere una stretta correlazione con la teoria degli orbitali molecolari, e quindi ha un approccio diverso dal metodo di Pauling, sebbene i risultati siano molto aderenti. La conversione dalla scala di Mulliken a quella di Pauling si effettua con la formula seguente: xP = 1,35 * xM1/2 - 1,37Esistono anche altre scale, come ad esempio quella di Allred-Rochow, che si basa sull'interazione elettrostatica degli atomi. In particolare, avendo come Zeff (si calcola in modo approssimato con le regole empiriche di Slater) la carica nucleare efficace che il nucleo esercita sull'elettrone di legame (più esterno) e con r il raggio covalente dell'atomo, l'elettronegatività è così definita: xAR = 0,359 * Zeff / r2 + 0,744Sebbene esistano diversi modi per esprimere l'elettronegatività, essi rappresentano uno stesso concetto: gli elementi che tendono ad acquistare elettroni perché hanno il livello quasi completo hanno elettronegatività molto alta, mentre quelli che non hanno particolare propensione ad accettarne o addirittura tendono a cederli, avranno una bassa elettronegatività o saranno elettropositivi. Riportiamo qui una tabella periodica con le elettronegatività di Pauling (proveniente dalla pagina Wikipedia inglese):
|
Joomla! 1.5.14