|
Assicuratevi di aver completato la lettura della seconda pagina, prima di procedere! Il legame chimicoUn legame chimico si instaura fra due specie, spesso due atomi, per minimizzare l'energia associata al sistema, ed è di natura elettrostatica. In altre parole, un sistema tende a raggiungere spontaneamente uno stato di energia minore disponendo gli atomi in modo particolare. La differenza di energia fra lo stato iniziale, delle particelle separate, e quello finale, delle particelle "legate", cioè vincolate l'una all'altra, viene ceduta dal sistema di particelle all'ambiente sotto forma di calore. Questo avviene, ad esempio, in ogni combustione. Esistono vari modi con cui gli atomi si legano fra loro: alcuni legami sono più forti di altri, pertanto il loro livello energetico è minore rispetto ad altri e la lunghezza del legame è minore, nel senso che gli atomi sono più ravvicinati, perché tenuti insieme da forze attrattive più intense. I legami più forti, solitamente fra atomi in una molecola, sono detti primari, mentre quelli più deboli, spesso fra varie molecole, sono detti secondari. I legami primari rappresentano tutti uno stesso aspetto chimico e si distinguono solamente per l'elettronegatività degli atomi che ne prendono parte. Infatti: -> se la differenza di elettronegatività fra gli atomi coinvolti è bassa o nulla, si parla di legame covalente; Esiste un terzo tipo di legame, proprio degli metalli alcalini ed alcalinoterrosi, che è il legame metallico. Legame covalenteIl legame covalente si instaura fra atomi la cui differenza di elettronegatività è compresa fra 0 e 1,9. Consiste nella condivisione di coppie di elettroni (una o più) in modo da far raggiungere la configurazione più stabile, cioè quella che completa il livello esterno, agli atomi. Gli atomi più leggeri obbediscono infatti alla regola dell'ottetto, che impone agli atomi la tendenza a raggiungere una configurazione esterna di 8 elettroni.
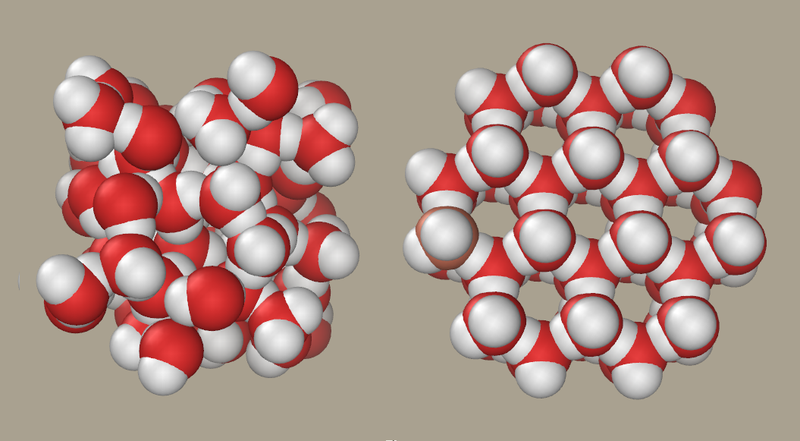
nelli'immagine: rappresentazione di un solo atomo di idrogeno, a sinistra, Se ad esempio prendiamo un atomo di ossigeno ed uno di idrogeno, vediamo che il primo ha sei elettroni nel livello esterno, mentre l'idrogeno uno solo. Se un primo atomo di idrogeno condividesse il suo elettrone con l'ossigeno e quest'ultimo ne condividesse uno con l'idrogeno, avremo un idrogeno legato stabilmente all'ossigeno, perché H completa il livello esterno avendo due elettroni a disposizione, di cui uno preso "in prestito" dall'ossigeno e che viaggia intorno ad entrambi i nuclei. Ora però l'ossigeno arriva a contare 7 elettroni, di cui uno preso "in prestito" da H, quindi non aspetta altro che un secondo atomo di idrogeno per condividere un'ulteriore coppia, e raggiungere finalmente l'ottetto. In questo modo si forma la molecola d'acqua.
L'acqua è un composto molecolare formato da due atomi di idrogeno ed uno di ossigeno. Un atomo ed un altro possono condividere una, due o tre coppie di elettroni; in tal caso si parla di legame singolo, doppio o triplo. Aumentando il numero di elettroni condivisi, si rafforza il legame e quindi lo si rende più forte e più corto. [Esistono anche legami quadrupli, quintupli e sestupli, generalmente solo per elementi del blocco d, ma sono più rari dei singoli, doppi e tripli.] Se la differenza di elettronegatività è molto bassa o è nulla (da 0 a 0,5), il legame covalente è omopolare (apolare, puro). Questo significa che gli elettroni sono equamente condivisi fra i due atomi, come accade per le molecole di atomi uguali non metallici. Un esempio: il legame H-H, O-O, N-N. Gli elettroni trascorrono metà del tempo sui due atomi e non hanno preferenza per uno dei due. Se la differenza di elettronegatività è più alta (da 0,5 a 1,9), il legame covalente è eteropolare (polare). Un atomo più elettronegativo tende a "tirare" un po' la nube elettronica dalla sua parte, facendo sì che gli elettroni stiano per più tempo su di esso. Un esempio: il legame H-Cl, H-O. In questo caso si forma un dipolo elettrico: una molecola che ha una parte leggermente più negativa ed una parte leggermente più positiva: questo è il caso dell'acqua, solvente polare.
Nelli'immagine: il legame tra idrogeno (atomo a sinistra) e cloro (atomo a destra) è covalente polare. In casi particolari, per esempio se l'atomo può fare più legami per ottenere l'ottetto ma l'altro non ha a disposizione abbastanza elettroni, ma ha tuttavia orbitali disponibili, allora può avere luogo un legame covalente coordinato (dativo), in cui entrambi gli elettroni condivisi per il legame provengono dallo stesso atomo, il donatore, mentre quello che li riceve in condivisione si chiama accettore. Si ritrova spesso in reazioni acido-base. Vediamo alcuni semplici esempi: H-H -> legame covalente omopolare singolo C-Cl -> legame covalente polare singolo
APPROFONDIMENTO: per una trattazione un po' più precisa sul legame covalente, sarà fornito qui un link a breve
Legame metallicoSe gli atomi non hanno abbastanza elettroni per raggiungere l'ottetto, come nel caso dei metalli, bisogna trovare un espediente (provando a fare un legame covalente "ordinario" fra atomi di metalli, ci si accorge che l'ingombro è eccessivo per raggiungere l'ottetto). Ci vorrebbero molti atomi per avere un numero sufficiente di elettroni. Per ovviare al problema, i metalli delocalizzano completamente i loro elettroni su tutto il volume. In altre parole, i nuclei del metallo, tutti positivi, si dispongono nello spazio e vengono tenuti assieme da una nuvola elettronica completamente sparsa fra di essi, perché nessun elettrone compete più ad alcun atomo individualmente, ma alla totalità degli atomi collettivamente, fornendo grande stabilità. Questo modo di condividere gli elettroni, che può essere considerato una variante del legame covalente, è detto legame metallico.
Nelli'immagine: immaginiamo di avere tantissimi atomi di rame; questi, in un campione puro, Questo ha alcune importanti implicazioni sulle proprietà dei metalli. Non esistono vere e proprie "molecole" di metalli: il reticolo è pressoché uguale in tutti i punti, quindi si possono separare parti di varie masse corrispondenti sempre alla stessa sostanza, a differenza dei composti covalenti che hanno una precisa formula chimica. Inoltre, il fatto di avere gli elettroni mobili su tutto il volume, rende i metalli particolarmente adatti a condurre l'elettricità (spostamento di elettroni sotto differenza di potenziale) ed il calore (l'agitazione termica del reticolo si propaga molto facilmente), sono duttili e malleabili.
APPROFONDIMENTO: per interpretare il legame metallico mediante gli orbitali molecolari, cioè secondo la teoria delle bande, sarà fornito qui un link a breve
Legame ionicoIl legame ionico si viene a formare quando i due elementi hanno elettronegatività molto diverse: in questo caso, l'attrazione degli elettroni per uno dei due atomi è così forte che si può considerare la nuvola elettronica completamente spostata su di esso. Nella pratica, un elettrone viene strappato da un atomo all'altro e si formano due ioni, un catione (carica positiva) ed un anione (carica negativa), che si attraggono per interazione elettrostatica (forze di Coulomb). Dunque, si possono avere legame con rapporti 1:1, ma anche fra due atomi carichi positivamente ed uno doppiamente negativo, due anioni ed uno ione +2, e tante altre combinazioni.
Nelli'immagine: un atomo di sodio cede volentieri un elettrone, un atomo di fluoro lo accetta volentieri. Il legame può formarsi in qualsiasi direzione, data la sua natura elettrostatica, ed è generalmente molto forte. I composti ionici, di solito, sono solidi ad alte temperature di fusione. Come per i metalli, non si può parlare di molecola: i composti ionici sono reticoli ben organizzati di ioni a cariche alternate, che rispondono a varie geometrie, i cristalli. Per questa ragione, è improprio parlare di "molecola" di sale NaCl, perché in realtà ogni atomo di Na si trova vicino a sei atomi di Cl, e per ogni atomo di Cl ci sono intorno sei atomi di Na.
Nelli'immagine: una parte della struttura del sale da cucina, NaCl. Se si proseguisse con la struttura, Dunque, è sbagliato parlare di "massa molecolare" per i solidi ionici, ma ci si può riferire alla massa della formula minima, la massa formula, quindi considerando i rapporti minimi di combinazione fra ioni positivi e negativi (nel caso del sale da cucina, Na:Cl = 1:1).
APPROFONDIMENTO: per saperne di più sui composti ionici ed i reticoli cristallini, sarà fornito qui un link a breve
Su questa pagina si proseguirà con le teorie dell'ibridazione, della risonanza, e degli orbitali molecolari; della geometria e della teoria VSEPR.
|
Joomla! 1.5.14